预后常用词
DCR
DCR(Disease Control Rate)意为疾病控制率。通常包括三个方面:
- 完全缓解(CR, Complete Response):肿瘤完全消失。
- 部分缓解(PR, Partial Response):肿瘤体积明显减少。
- 疾病稳定(SD, Stable Disease):肿瘤没有明显的增长或缩小。 因此,疾病控制率=(完全缓解+部分缓解+疾病稳定)/总治疗人数×100%。
ORR & PFS & OS
评估肿瘤治疗效果的指标:
- ORR(Objective Response Rate):客观缓解率。 这是测量肿瘤治疗效果的一个参数,指的是所有接受治疗的患者中有明显肿瘤体积缩小(包括部分缓解和完全缓解)的百分比。部分缓解指的是肿瘤大小减少了一定比例且保持一段时间,而完全缓解指的是肿瘤完全消失。其实就是包含了 CR 和 PR。
- PFS(Progression Free Survival):无进展生存期。 PFS指的是从治疗开始到肿瘤进展(比如肿瘤体积增大或出现新的病灶)或患者死亡(任何原因)的时间长度。PFS是用来评估治疗控制肿瘤生长的有效性的。
- OS(Overall Survival):总生存期。 OS指的是从接受治疗开始到患者死亡(由于任何原因)的时间长度。总生存期是评估某种治疗对延长病人生命的最终效果的重要指标。
医学概念
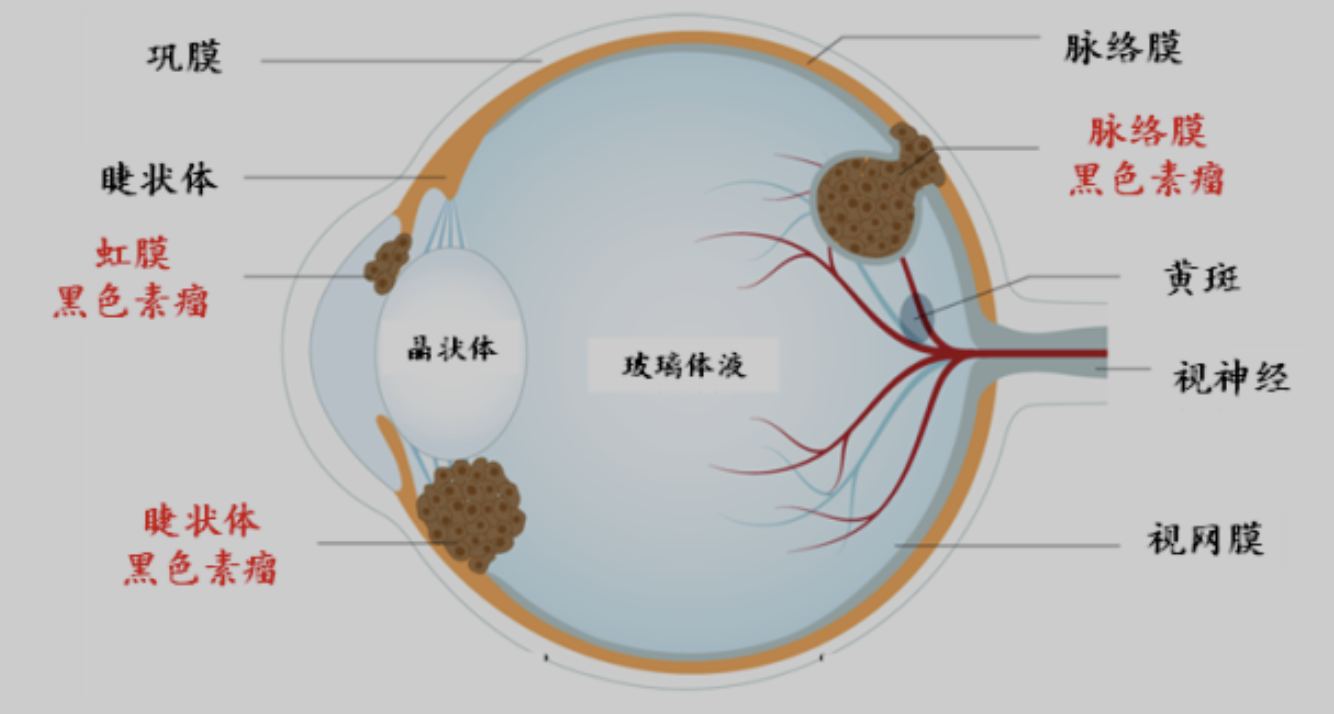
葡萄膜
眼睛中的葡萄膜(Uvea)是中间的血管层,负责为眼睛提供血液供应。它包含了以下三部分:
- 虹膜(Iris):是眼睛最前面的部分,为眼球提供颜色,并含有一个中央孔洞称作瞳孔。虹膜的主要功能是控制进入眼睛的光线量,通过调整瞳孔大小来实现。
- 睫状体(Ciliary Body):紧邻虹膜的后方,包含睫状肌和睫状突。它的主要功能是通过睫状肌的收缩和放松,调整晶状体的形状,从而帮助眼睛调焦以适应不同远近的视觉需求。此外,睫状体还负责产生房水,这是填充在眼前房和眼后房(位于虹膜、晶状体和角膜之间的小空间)中的液体,用于为眼睛前部提供营养并维持眼球的压力。
- 脉络膜(Choroid):位于视网膜之外和眼球壁之内的部分,是一层富含血管的薄膜,负责为视网膜提供氧气和营养。脉络膜包含大量的血管,是眼内最血管密集的结构。它帮助调节眼内温度和体积,还支持视网膜的功能。
葡萄膜的炎症称为葡萄膜炎(Uveitis),这是一种潜在的严重眼病,可以影响一个或多个葡萄膜的部分。由于葡萄膜的高血管性,它也是肿瘤(如葡萄膜恶性黑色素瘤)的一个常见部位。
黑色素细胞
黑色素细胞(Melanocytes)主要存在于以下几种组织中:
- 皮肤:黑色素细胞主要分布在皮肤的基底层,它们负责产生一种名为黑色素(melanin)的色素,这种色素可以保护皮肤免受紫外线的伤害。黑色素的多少和分布情况决定了皮肤、毛发和眼睛的颜色。
- 毛发:黑色素细胞同样存在于毛囊中,为毛发提供颜色。
- 眼睛:黑色素细胞在眼睛的几个部位都有分布,包括虹膜(赋予眼睛颜色)、睫状体和脉络膜(眼底)。在虹膜中,黑色素为眼睛提供不同的颜色,而在脉络膜中,黑色素有助于吸收多余的光线,提高视觉的清晰度。
- 内耳:尽管数量不多,黑色素细胞也存在于内耳结构中,其具体功能还未完全明确,但认为可能与听力保护有关。
- 中枢神经系统(如脑和脊髓)和心血管系统:在这些部位,黑色素细胞的存在较为罕见,其功能和意义仍在研究中。
黑色素细胞除了在上述组织中有所分布外,其重要功能之一是通过产生黑色素来保护DNA免受紫外线辐射造成的伤害,减少皮肤癌的风险。然而,黑色素细胞自身在某些条件下也可能发生变异,形成黑色素瘤(Melanoma),这是一种严重的皮肤癌类型。
参加临床研究
在医学领域,"参加临床研究"通常指的是患者或健康志愿者参与由医疗研究机构或医院进行的科学研究项目。这些研究旨在评估新的治疗方法、药物、医疗设备或者干预措施的安全性、有效性、副作用等。临床研究对于发现新治疗方法和改进现有治疗方法至关重要。
临床研究通常分为几个阶段:
- 第一阶段(I期):主要评估新治疗方法的安全性,确定药物的最佳剂量,研究涉及的参与者数量较少。
- 第二阶段(II期):进一步评估治疗的有效性和安全性,确立初步的剂量范围,参与者数量比I期多。
- 第三阶段(III期):在更大群体中比较新治疗方法与当前最佳治疗方法或安慰剂的效果,以此确认其疗效和安全性,参与者数量较大。
- 第四阶段(IV期):也称为市场后研究,是药物或治疗方法上市后进行的研究,旨在长期监控疗效和搜集关于副作用的信息。
参加临床研究有可能让患者接触到尚未广泛使用的最新治疗方法,但也伴随着一定的风险和不确定性。因此,在决定是否参与临床研究前,患者及其家属应充分了解研究的目的、潜在的好处和风险,并与医疗团队进行深入的沟通。研究参与者的权利与隐私受到法律和伦理准则的保护,他们有权在任何时刻退出研究。说白了就是可以提出终止实验的小白鼠。
免疫豁免区
"免疫豁免区"(immune-privileged site)的概念指的是,眼睛等特定器官具有一种独特的生物学性质,能够限制免疫系统的活动,减少免疫应答,以防止对自身组织的炎症或损伤。这并不意味着免疫系统完全不会对眼睛生效,而是指眼睛具有一定机制减缓和抑制免疫反应,以保护视觉功能不受免疫系统激活所造成的可能损害。眼睛(以及大脑、睾丸等)被视为“免疫特权”部位主要是基于以下几点:
- 物理隔离:血眼屏障(包括血视网膜屏障和血房水屏障)阻止了大分子和某些免疫细胞自血液进入眼睛内部,减少了免疫介导的炎症反应。
- 免疫抑制环境:眼内环境富含免疫抑制因子,例如TGF-β(转化生长因子-β)和α-MSH(α-黑色素刺激激素),这些因子可以调节局部免疫应答,抑制炎性细胞的活动。
- 抗原呈递能力差:眼部的某些组织如角膜缺乏充分的抗原呈递细胞,这限制了免疫系统识别并攻击被视为外来的抗原的能力。
尽管眼睛有这样的免疫特权,但在某些情况下,如感染、外伤或自身免疫反应,免疫系统仍会介入,有时可能导致视觉损害。因此,保持眼睛的免疫特权状态对于维护眼睛健康和视力至关重要。
免疫检查点分子
免疫检查点分子是一类在免疫系统中发挥关键调节作用的蛋白质。它们位于免疫细胞表面,例如T细胞,是免疫系统通过识别和响应外部信号进行自我调节的一部分。免疫检查点分子可以被看作是免疫系统的“刹车”和“油门”:一些免疫检查点蛋白(如CTLA-4和PD-1)起到抑制作用,帮助避免对健康组织的攻击,维持自身耐受,防止自身免疫疾病的发生;而另一些则有助于激活免疫反应。
免疫检查点分子的主要功能: - 维持免疫平衡:通过调节免疫反应的强度和持续时间,免疫检查点分子帮助维持机体免疫系统的平衡。 - 防止自身免疫反应:通过下调T细胞活性,免疫检查点防止免疫系统攻击自身组织,这对于防止自身免疫疾病至关重要。 - 调节免疫应答:在感染或肿瘤中,免疫检查点分子可以影响免疫细胞如何响应,包括它们是否被激活、攻击目标的强度、以及何时终止反应。
肿瘤细胞通过上调PD-L1等免疫检查点配体来“欺骗”免疫系统,抑制T细胞的活性,逃避免疫监视。通过应用免疫检查点抑制剂,如PD-1/PD-L1和CTLA-4抗体,可以阻断这种抑制信号,释放免疫系统的“刹车”,激活T细胞攻击肿瘤细胞。这种策略已被证实对多种癌症类型有效,提供了一种重要的癌症治疗手段。 然而,释放免疫系统的“刹车”同时可能导致对正常细胞的攻击,引起免疫相关副作用。因此,在使用免疫检查点抑制剂时需要仔细监测和管理患者的反应。
远隔效应
远隔效应(也称为消融效应,英文名为"abscopal effect")是一种罕见但有趣的现象,指放射治疗直接作用于某个特定肿瘤部位后,远离该治疗区域的其他未治疗的肿瘤部位也发生了缩小或消失的现象。简而言之,远隔效应是指在放疗目标区域之外的肿瘤组织上观察到的治疗效果。
远隔效应的机制目前还不完全清楚,但普遍认为与患者自身免疫系统的激活有关。一种理论认为放射治疗可以引起肿瘤细胞死亡并释放肿瘤相关抗原,这些抗原被免疫系统捕捉并识别,激活特异性的免疫反应。随后,这种激活的免疫反应不仅能攻击被放疗直接作用的肿瘤细胞,也能攻击体内同样带有这些抗原的其他肿瘤细胞,从而产生了远隔部位的肿瘤抑制效果。
基因
基因突变
基因突变分三种情况:增、删、改。即:
- 基因扩增,是指基因组中某一段DNA序列的复制数目增加,这导致该基因或基因片段的拷贝数增加。基因扩增可能导致该基因表达水平的提高,因为拷贝数的增加通常意味着产生更多的mRNA和蛋白质。因此,如果一个基因具有促进细胞增殖、生长或存活等功能,其扩增可能会导致这些功能的“增强”,但不一定是效用成倍增加。与发癌过程有关的一些致癌基因(Oncogenes),如HER2/neu基因在某些乳腺癌中的扩增,就是一个典型例子。这种扩增可能导致肿瘤细胞的过度生长和分裂。
- 基因丢失(或称为基因缺失),意味着某一段DNA序列从基因组中完全丢失。这通常导致该基因编码的蛋白质完全丧失,进而导致相关的生物学功能丢失,如果影响到重要的调控基因或肿瘤抑制基因,可能导致疾病发生。
- 基因改变(或称为点突变、序列改变),可能会导致编码蛋白质的氨基酸序列发生改变,从而影响蛋白质的结构和功能。这种改变可能导致蛋白质功能丧失、功能减弱、功能增强或获得新的功能。
总的来说,基因突变对基因功能的影响复杂多变,不仅包括功能的丧失或减弱,也可能包括功能的增强或获得新功能。基因扩增通常与基因表达水平的增加相关,这可能导致正常细胞生理功能的扰动,并在某些情况下促进疾病的发展。
外显子 & 内含子
在基因的DNA序列中,外显子(Exons)和内含子(Introns,有时候会简写成 IVS)是两种主要的序列类型,它们在基因表达和蛋白质合成中扮演不同的角色。
- 外显子是基因序列中编码蛋白质的那部分DNA片段。在基因表达的过程中,外显子中的信息会被转录成mRNA,并最终翻译成蛋白质。因此,外显子直接决定了由特定基因编码的蛋白质的氨基酸序列。在基因结构中,外显子可以是连续的,也可以由多个外显子和内含子交替组成。在后一种情况下,RNA剪接过程会移除mRNA前体中的内含子序列,将外显子连接起来,形成成熟的mRNA。
- 内含子是基因序列中不编码蛋白质的那部分DNA片段。虽然内含子在基因的转录过程中被拷贝到mRNA前体中,但在成熟的mRNA形成之前,通过RNA剪接的过程,内含子会被从mRNA前体中切除。内含子并不直接参与蛋白质的编码,但它们在基因表达调控、RNA剪接以及增加基因产物的多样性方面可能具有重要作用。例如,通过可变剪接的机制,一个基因可以产生多个具有不同功能的蛋白质变体。
总的来说,外显子和内含子是基因组组织的基本元素,它们共同参与并调控基因表达过程。外显子的序列决定了蛋白质的结构和功能,而内含子虽然不编码蛋白质,却在RNA加工和基因表达调控中发挥作用。
NF1
NF1基因是编码神经纤维蛋白(neurofibromin)的基因,属于肿瘤抑制基因,参与调控细胞的增长和分化。神经纤维蛋白是一种GTPase激活蛋白(GAP),其主要功能是通过加速RAS蛋白从活性的GTP结合状态向非活性的GDP结合状态的转换,进而负向调节RAS信号通路。RAS信号通路在许多细胞过程中起核心作用,包括细胞生长、分化和存活。
NF1基因的突变或缺失会导致神经纤维蛋白的功能丧失或降低,使RAS信号通路过度激活,从而可能导致细胞的非正常增生和肿瘤的形成。NF1基因突变与一种称为神经纤维瘤病1型(Neurofibromatosis Type 1,简称NF1)的遗传性疾病密切相关。NF1疾病的特征包括皮肤上的咖啡牛奶色斑点、皮下和皮肤表面的神经纤维瘤、虹膜上的Lisch结节等,患者还可能出现学习障碍以及其他神经系统和非神经系统的并发症。
此外,NF1基因突变还与其他类型的肿瘤风险增加有关,包括恶性周围神经鞘瘤、脑瘤和白血病等。因此,NF1基因在维持细胞正常生长和防止肿瘤形成中扮演着非常重要的角色。
FLT3
FLT3(Fms相关酪氨酸激酶3,Fms-Like Tyrosine Kinase 3)基因编码一种受体酪氨酸激酶,这种酪氨酸激酶在细胞生长、分化以及存活的调节中起重要作用。FLT3主要在造血干细胞以及早期造血前体细胞中表达,对于正常的造血和免疫系统的发育至关重要。
FLT3通过与其配体(FLT3 ligand)结合启动信号转导途径,进而激活一系列下游的信号分子和核心转录因子。这一过程影响多种细胞功能,包括细胞增殖、分化和凋亡。因此,FLT3在维持造血系统的正常功能和免疫反应中发挥着重要作用。
FLT3基因突变,特别是内部串联重复(Internal Tandem Duplication, ITD)的突变,是某些类型白血病(尤其是急性髓细胞白血病,AML)中识别到的重要预后因素。FLT3-ITD突变会导致FLT3信号过度激活,促进白血病细胞的无控制增殖和存活,从而加速疾病的进展。FLT3突变的AML患者通常预后较差,因此FLT3已成为靶向治疗的重要目标,开发了一系列针对此激酶的抑制剂以治疗携带FLT3突变的白血病患者。
EP300
EP300(E1A结合蛋白P300)基因编码的是P300蛋白,这是一种广泛参与细胞过程的转录共激活因子。P300具有组蛋白乙酰转移酶(HAT)活性,能够通过乙酰化组蛋白和非组蛋白质靶标来调节转录,从而影响基因表达的调控。通过这种方式,P300在许多重要的细胞功能中发挥作用,包括:
细胞增殖与分化:P300通过调节与细胞周期调控和分化相关的基因表达,影响细胞的增殖和特定类型细胞的成熟发育。
DNA损伤修复:通过乙酰化特定的蛋白质,P300参与DNA损伤的感应和修复过程,维持基因组的稳定性。
细胞凋亡:P300还参与了调节细胞死亡相关基因的表达,对平衡细胞生存和死亡具有重要作用。
响应环境信号:P300通过乙酰化,影响多种信号通路,帮助细胞对环境变化做出反应。
EP300基因突变和功能失调与多种疾病的发展有关,尤其是与某些癌症的发生密切相关。例如,在某些肿瘤中,EP300的缺失或突变可能导致对抑癌基因表达的调控失效,促进肿瘤的发展和进展。此外,EP300的某些突变也与一些罕见的遗传性疾病有关,这些疾病包括影响神经发育和功能的病症。
因此,EP300作为一个关键的转录共激活因子,对于正常的细胞功能和整体生理过程至关重要。研究EP300的功能和它在疾病中的作用可以帮助我们更好地理解这些疾病的分子机制,为开发新的治疗策略提供可能。
PDGFRA
PDGFRA(血小板衍生生长因子受体α)是编码血小板衍生生长因子受体α(PDGFRα)的基因。PDGFRα是一种细胞表面的受体酪氨酸激酶,它能够结合特定的配体,如血小板衍生生长因子(PDGF),从而激活多个下游信号通路,包括PI3K/AKT、RAS/RAF/MEK/ERK等,这些通路在细胞的生长、分化、迁移和存活中扮演关键角色。
PDGFRA基因的扩增或突变能够导致PDGFRα受体的过度激活,从而引起包括以下一些问题:
- 促进肿瘤形成和发展:PDGFRA基因的扩增或其激活性突变常见于多种肿瘤类型中,特别是胃肠道间质瘤(GIST)、胶质瘤和某些类型的白血病。PDGFRA的异常激活通过持续的细胞信号传递促进肿瘤细胞的无控制增殖和存活。
- 影响治疗反应:PDGFRA基因扩增或突变的存在可能影响患者对某些药物的反应,特别是针对PDGFRA或相关信号通路的靶向治疗。例如,在GIST中,PDGFRA激活性突变可能影响患者对伊马替尼等酪氨酸激酶抑制剂的敏感性。
- 可能导致药物抵抗:在某些情况下,即使最初对靶向PDGFRα的治疗有反应,PDGFRA基因的进一步突变也可能导致治疗抵抗,需要更改治疗方案或寻找新的治疗方法。
- 影响预后:PDGFRA基因的扩增或特定的突变模式在某些情况下可能与疾病的临床表现和预后相关联,可能影响疾病进展的速度和治疗结果。
值得注意的是,PDGFRA基因扩增或突变的影响可能因肿瘤类型和患者个体的具体情况而有所不同,因此在设计治疗计划时需要综合考虑这些因素。针对PDGFRA扩增或突变的精准医疗策略,正在不断地研究和开发中。
KIT
KIT基因编码一种受体酪氨酸激酶,称为c-KIT或CD117。c-KIT是一种细胞表面受体,对细胞的生长、分裂、存活和分化过程起着至关重要的作用。c-KIT通过结合其配体干细胞因子(SCF,也称为钢因子,Stem Cell Factor)激活多条信号传导途径,这些途径包括PI3K/AKT、RAS/RAF/MEK/ERK等,从而调控细胞命运决定。
KIT基因在多种细胞类型和组织中表达,尤其是在造血干细胞、生殖细胞、黑色素细胞和肠道神经系统的间质细胞(称为Cajal间质细胞)等具有重要作用。因此,KIT基因及其蛋白产品在正常的造血、生殖、肠动力以及皮肤色素生成等过程中发挥着关键作用。
KIT基因的突变或异常激活与多种类型的癌症有关。例如,在胃肠间质瘤(GISTs)、某些类型的白血病、嗜酸性粒细胞增多症以及其他肿瘤中,发现了KIT基因的激活性突变。这些突变通常导致c-KIT受体的持续激活,即使在没有其配体SCF的情况下也会激活,从而促进肿瘤细胞的生长和存活。基于这一机制,c-KIT成为了一些靶向疗法的目标,例如伊马替尼(Imatinib)就是针对具有活性KIT突变的GIST患者的有效治疗药物之一。
KIT基因扩增可能会导致以下问题:
- 细胞增殖的促进:c-KIT受体的过度激活可以促进细胞迅速增殖,特别是在那些本来就对c-KIT信号敏感的细胞类型中,如造血干细胞、黑色素细胞等。这可能导致细胞过度生长和肿瘤的形成。
- 肿瘤的发展:尤其是在某些类型的肿瘤中,如胃肠道间质瘤(GIST)、某些白血病、黑色素瘤等,KIT基因的异常激活(包括扩增)与这些肿瘤的发生有关。在这些情况下,c-KIT的持续信号激活为肿瘤细胞的生存和扩张提供了生物学基础。
- 治疗反应的影响:KIT基因扩增或其他类型的激活突变可以影响患者对特定治疗的反应。例如,KIT扩增的GIST患者可能对某些靶向c-KIT的药物(如伊马替尼)有良好反应,但也可能因为基因异常的多样性而对这些治疗产生抵抗。
预后影响:在某些研究中,KIT基因扩增或突变与特定类型肿瘤中的疾病进展和较差预后相关联。
MAF
MAF基因编码一个属于MAF蛋白家族的转录因子,这一家族的成员参与调节细胞增长、分化和维持特定类型细胞的功能。MAF基因的扩增和突变,特别是在血液癌症中,已被发现与疾病的发展有关。
- 多发性骨髓瘤:MAF基因的扩增是多发性骨髓瘤中一个已知的遗传异常之一。MAF过度表达可促进肿瘤细胞的增殖,并对治疗产生抵抗。MAF扩增或过表达的患者可能需要更精准的治疗策略。
- 其他血液病:MAF基因扩增或突变也可能在其他类型的血液病中发现,如某些类型的非霍奇金淋巴瘤等。
CBFB
CBFB基因 CBFB基因编码核心结合因子β亚单位(CBFβ),它是与RUNX家族蛋白结合形成复合体的一个关键成分。CBFβ-RUNX复合体在血液细胞的发育中起重要作用,特别是在调控造血干细胞的分化中。
- 急性髓性白血病(AML):CBFB基因与MYH11基因的融合是因染色体易位而导致的,这种融合基因在一部分AML患者中可以发现。CBFB-MYH11融合蛋白具有抑制正常造血和促进白血病细胞增殖的作用。
- 增生和分化的异常:CBFB基因的扩增或突变可能干扰正常的细胞增生和分化过程,导致血液细胞异常发育,并促进恶性转化。
BRAF
BRAF基因是编码B-Raf蛋白的基因,B-Raf蛋白是一种酪氨酸激酶,属于RAF激酶家族,这个家族在细胞的生长和分裂过程中发挥着重要作用。BRAF基因通过编码B-Raf蛋白,参与到多种生物学过程中,特别是RAS-RAF-MEK-ERK信号传导通路中,这一通路在调控细胞的增殖、分化、存活以及凋亡等方面起着核心作用。
BRAF基因的突变在多种人类癌症中被发现,其中最为人熟知的是V600E突变,这种突变导致B-Raf蛋白的激酶活性增加,从而持续激活下游的MEK-ERK信号通路,促进细胞的非正常增殖和肿瘤的形成。BRAF基因的突变尤其在恶性黑色素瘤(melanoma)、甲状腺癌、结直肠癌等癌症中较为常见。
由于BRAF基因突变的重要性,针对特定BRAF突变的靶向治疗已经成为某些癌症治疗策略的一部分。例如,在含有BRAF V600E突变的恶性黑色素瘤患者中,使用BRAF抑制剂(如vemurafenib和dabrafenib)可以有效抑制肿瘤细胞的生长。
总的来说,BRAF基因在维持正常细胞功能和癌症发生发展中都扮演着重要角色,对于BRAF突变的研究有助于精准诊断和治疗相关癌症。
病理诊断书
BRAF(-)
BRAF 这里是一种基因,也可以是某些其他实体,括号里的减号代表阴性,通常意味着正常。代入到具体的情景中就是 BRAF 这种基因没有发现突变迹象。 如果是 + 就代表着阳性,意思就是前者有突变(基因)或有表达(蛋白质或抗体等实体)。而 + 又分多种形式:
- 弥漫+(Diffuse+):"弥漫+"通常用来描述某种特定标记物的表达模式。比如 SOX10(弥漫+),指的是SOX10在检测的组织样本中广泛(弥漫性)和积极(阳性)地表达。这意味着细胞广泛地表达SOX10蛋白,这通常通过免疫组化(immunohistochemistry,IHC)这样的技术来检测和验证。
- 灶性+(Focal+):比如"HMB45(灶性+)"描述的是HMB45抗体染色的表达模式,指的是抗体标记呈现出局部或斑块状的阳性反应,而不是广泛或整个组织样本中均匀分布。这种局部或斑块状的阳性反应意味着肿瘤中有一部分细胞表达了Pmel 17蛋白,而其他部分可能没有表达或表达较少。